|
Análisis termodinámico:
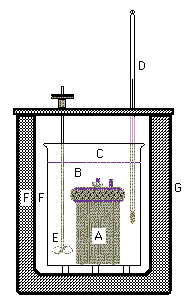
Supongamos que el sistema (constituido por la vasija, el agua, la bomba,
la muestra y el oxígeno) se encuentra a una inicialmente temperatura
Tinic y a una presión Pinic. Cuando se produce
la combustión la muestra aumenta su temperatura hasta Tfinal
y la presión hasta Pfinal. La bomba y su contenido no
sufren cambio de volumen, pero se produce una ligera expansión del
agua en el baño debido al cambio de la temperatura. Este proceso
es seudoadiabático y no hay transferencia de calor. Surgen también
dos tipos de trabajo que pueden considerarse despreciables: uno debido
a la expansión del agua y otro debido a la corriente eléctrica
utilizada para calentar el alambre que produce la ignición de la
muestra.
Por lo tanto, es posible calcular el calor (Q) que debe ser transferido
para enfriar el sistema (vasija, agua, bomba, productos la combustión
y oxígeno restante) de tal forma que se vuelva a la temperatura
inicial Tinic. Este calor es calculado multiplicando
la capacidad calorífica del sistema (Ccal) por la variación
de temperatura:
Q = Ccal(Tinic - Tfinal) = - CcalDT
La capacidad calorífica del sistema puede ser determinada de
varias formas, pero la más común es a partir de una sustancia
patrón, normalmente ácido benzoico
Qcal (J) = 26425 (masa de ácido benzoico) + 5858 (masa
del alambre antes - masa del alambre después)
Ccal (J/K) = Qcal / [Tfinal, ac. benzoico
- Tinicial, ac. benzoico]
El balance total del proceso podría escribirse como:
[muestra + oxígeno](Tinic, Vinic, Pinic)
---->[productos de la combustión](Tinic, Vinic,
P')
De tal forma que el resto del sistema (vasija, agua y bomba) no sufre
ningún cambio.
Dado que este proceso no implica ningún trabajo:
DUvol = Q = -Ccal DT
La diferencia entre la presión inicial Pinic y final
P' suele ser pequeña, y la variación de la energía
con respecto a la presión a temperatura constante es también
pequeña para la mayor parte de las sustancias, así que la
energía necesaria para llevar a los productos de nuevo a Pinic,
Tinic y un nuevo volumen V' es despreciable.
La variación molar de energía DUm
en
el proceso:
[muestra + oxígeno](Tinic, Vinic, Pinic)
----> [productos de la combustión](Tinic, Pinic,
V')
es DUm = - (CcalDT
- qcorr)/n.
Donde n es el número de moles
de la muestra y qcorr es una pequeña
corrección causada por la combustión del alambre:
qcorr = 5858 (malambre antes - malambre después)
La variación de entalpía en este proceso (DHm)
se calcula:
DHm = DUm
+ D(PVm) = - (CcalDT
- qcorr)/n + RT Dngas
Donde Dngas
es la diferencia, entre reactivos y productos, de moles de compuestos en
estado gaseoso por mol de reactivo. El cálculo de Dngas
requiere escribir la ecuación ajustada de la reacción
de combustión.
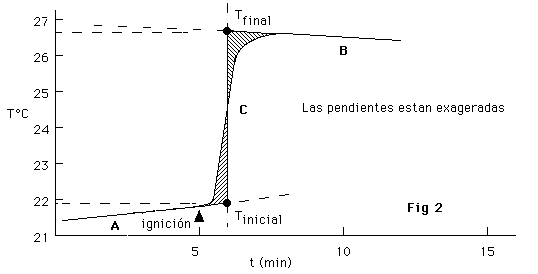
Esta variación de entalpía corresponde a la reacción
de combustión a la temperatura experimental (tomando como valor
la temperatura media de la Figura 2, la que corresponde al punto
C) y presión de aproximadamente
20 atm. Si se desean realizar medidas muy precisas, los valores pueden
ser ajustados a las condiciones estándar, 1 atm, utilizando las
propiedades de los materiales implicados. Esta corrección suele
ser muy pequeña, y por lo tanto se considera que la entalpía
así determinada es el calor estándar de reacción (DrH0).
Este Valor puede combinarse con los calores estándar e formación
de los productos, normalmente agua y dióxido de carbono, para obtener
el calor estándar de formación de la muestra (DfH0)
utilizando la Ley de Hess.
|