5. PHA MAS COMUNES
Los dos compuestos más comunes son: el polihidroxibutirato (PHB) y el copolímero de polihidroxibutirato y polihidroxivalerato conocido como polihidroxibutirato-valerato (PHBV).
Ambos compuestos son suministrados mediante la empresa Bioglutamic S.L., fundada en 2005 en Cataluña y galardonada con el premio Innova de la UPC, patrocinado por la empresa Solvay

Los primeros procesos desarrollados para la producción de PHA en microorganismos se realizaron mediante fermentación utilizando a la bacteria Ralstonia eutropha, la cual es capaz de producir PHB a partir de glucosa, o polihidroxibutirato-valerato (PHBV) a partir de glucosa y propionato, sustratos cuyo alto costo incidía en el precio final del polímero obtenido.
5.1 Propiedades y Aplicaciones de PHB y PHBV
5.2.1 Propiedades mecánicas del PHB
5.2.2 Síntesis de PHB en Azotobacter
5.2.3 Producción de PHB en Escherichia coli recombinante
5.1 Propiedades y Aplicaciones de PHB y PHBV
** Entre las aplicaciones potenciales de los PHA se encuentran las industrias químicas y farmacéticas, principalmente debido a su biodegradabilidad.
El PHB tiene propiedades similares al propileno, aunque es más duro y quebradizo. El PHBV es utilizado como material de empaque. Se suele usar en contenedores de aceites, láminas y botellas
El homopolímero puro PHB es un termoplástico altamente cristalino y muy frágil, mientras que el copolímero de PHB con PHV es menos cristalino, más flexible y más fácil de procesar. Un nombre comercial de este copolímero es Biopol (desarrollado por la compañía Monsanto Co)
** Azotobacter chroococcum y Rhodospirillum rubrum son dos de las especies que pueden producir PHB de diferentes pesos moleculares. Además, bajo condiciones especiales de crecimiento, también pueden producir el copolímero PHBV a partir de sustratos simples, lo cual es importante ya que se evita recurrir a precursores tóxicos y costosos para producir el copolímero.
Las cepas aisladas son capaces de sintetizar y acumular el PHB y su copolímero en forma de gránulos intracitoplasmáticos de entre 0.2 y 3m. La extracción del PHB a partir de la biomasa se realiza mediante disolución en solventes orgánicos.
La distribución de pesos moleculares modifica las propiedades mecánicas y de biodegradabilidad. El agregado de ácidos orgánicos como el propiónico permiten obtener copolímeros más flexibles .
Es decir, las propiedades mecánicas del PHB pueden modificarse para cubrir diferentes aplicaciones que mejorarían sistemas tan diversos como el agrícola o el médico.
** Estos polímeros están siendo estudiados para diversas aplicaciones biomédicas, y normalmente requieren la presencia de enzimas para su degradación aunque pueden degradarse en gran variedad de medios.
Efectivamente, una aplicación del PHB es el recubrimiento de semillas (peleteado) a fin de ocluir bacterias y protegerlas de condiciones adversas aumentando su germinabilidad.
Como ejemplo de aplicaciones médicas podemos mencionar el uso de PHB como soporte para el crecimiento de células epiteliales. La regeneración de la piel en zonas de quemaduras es un problema clínico grave, especialmente porque para lograrlo es necesario regenerar también el tejido termal subyacente. Hasta ahora el procedimiento es sembrar keratinocitos provenientes del mismo paciente en cápsulas de Petri con un medio de cultivo apropiado. Una vez que las células han crecido hasta formar una monocapa, se la despega cuidadosamente del vidrio y se realiza el implante en el quirófano. El problema que se presenta es que las monocapas de piel son frágiles y se desgarran al depegarlas del vidrio por lo que un sustrato de PHB entre ambos serviría para aumentar la resistencia mecánica y reduciría el riesgo de desgarro. Además dado que el PHB es biocompatible y reabsorbible, se podría aplicar el PHB con las células directamente sobre el paciente.
Se han logrado grandes avances en la producción de PHB llevando a cabo la misma tanto en bacterias aisladas como insertando el gen que codifica la producción de PHB de una bacteria en plantas. Como se ha dicho anteriormente, también ha sido posible la obtención de PHB en zonas localizadas dentro de la planta. A su vez, en cada nueva cepa que se logra crear, se ensaya la capacidad de producción de PHB variando la fuente de carbono y las condiciones de cultivo.
Por un lado se ha aumentado la escala del proceso de producción, y por otro se ha conseguido que las cepas obtenidas por ingeniería genética se alimenten de lactosuero (un residuo de la industria de la leche). Esto no solo es provechoso para el cuidado del medio ambiente, sino que conlleva un doble beneficio para las empresas lácteas: se le da valor soeconómico a un desecho, y se evitan los costos de su procesamiento previo a la liberación al ambiente.
A continuación se dedica un apartado a hablar de las propiedades mecánicas del PHB, y los dos siguientes a éste tratan de reflejar la síntesis del PHB mediante dos tipos distintos de bacterias: azotobacter y escherichia coli.
Trozos de PHB extraído de cultivos bacterianos.
izq) Azotobacter crecida en medio mínimo con 3% de glucosa
der) E. coli recombinante (contiene los genes estructurales pha de Azotobacter ) crecida en medio mínimo con 2,5 % de lactosa.
5.2.1 Propiedades mecánicas del PHB
El polihidroxibutirato, primer miembro conocido de esta familia, tiene propiedades mecánicas semejantes a la del polipropileno con la ventaja agregada de su biodegradabilidad. Sin embargo, en la actualidad no es un material que pueda desplazar al polipropileno, debido a que su diferencia de precio es muy grande.
El PHB es un termoplástico que puede ser procesado mediante técnicas convencionales de extrusión e inyección.
Las propiedades mecánicas en ensayos de tracción de este polímero son útiles para evaluar posibles aplicaciones médicas, ya que su biocompatibilidad los convierte en potenciales materiales de reemplazo de tejidos muertos o no funcionales, soporte para liberación lenta de medicamentos o de crecimiento de células, material de sutura y de recubrimiento de implantes, ...
El PHB posee un comportamiento similar al de un elastómero especialmente cuando se combina con un plastificante que le confiere mayor flexibilidad y ductilidad.
La curva de tracción se representa mediante un gráfico de la tensión nominal F/Ao (donde F es la fuerza aplicada y Ao la sección transversal inicial) , en función de la elongación l= l/lo ( lo y l son la longitud inicial e instantánea de la muestra, respectivamente)
La figura muestra el aumento en la tenacidad del PHB cuando se le agrega un plastificante (en este caso Tween 80 al 1.5%). Las curvas 2 y 3 corresponden a muestras de una misma película donde la única diferencia es la dirección en la que fueron cortadas.
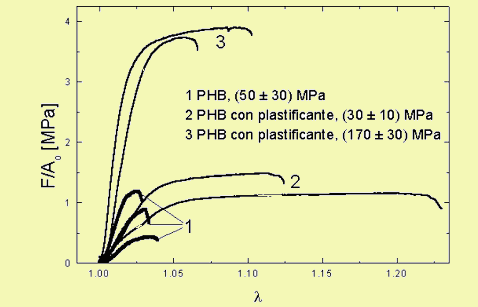
Curvas de tracción vs elongación en miniprobetas normalizadas de PHB y PHB plastificado.
Se indican los módulos tensiles
5.2.2 Síntesis de PHB en Azotobacter
Azotobacter es una bacteria productora de PHB aislada de muestras de suelo. Puede utilizar sacarosa o melazas de caña, un subproducto de la obtención de azúcar de caña muy barato para producir PHB. Otra característica importante de este microorganismo es que no forma cápsula, lo cual significa que no deriva la fuente carbonada para la síntesis de exopolisacáridos.
En esta bacteria el polímero se sintetiza mediante un camino metabólico que involucra tres enzimas: una b-cetotiolasa, que condensa dos moléculas de acetil-CoA para formar acetoacetil-CoA, una acetoacetil-CoA reductasa, que convierte este compuesto en 3-hidroxibutiril-CoA, y una polimerasa, que polimeriza los monómeros. Este camino metabólico es el que utilizan la mayoría de las bacterias productoras de PHB, tales como R. eutropha. En Azotobacter estas enzimas están codificadas por los genes phaB, phaA y phaC, que han sido clonados y caracterizados.
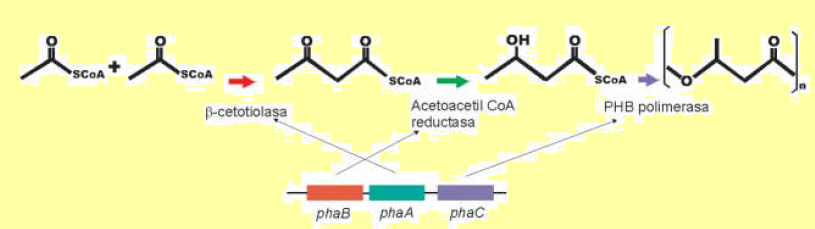
Esquema de la síntesis de PHB en Azotobacter
Existen otras proteínas involucradas en la regulación de la biosíntesis del polímero y en la formación de los gránulos intracitoplasmáticos. Se han identificado varias proteínas estructurales. Una de ellas son las fasinas, que se encuentran asociadas a los gránulos de PHA. Estas proteínas podrían afectar el tamaño y la pureza de los gránulos, ya que son importantes para la forma que el gránulo adquiere intracelularmente e impiden que otras proteínas puedan asociarse inespecíficamente, lo cual simplifica la purificación del polímero. La interacción entre las proteínas asociadas a los gránulos es prácticamente desconocida en todas las especies estudiadas hasta ahora. Sin embargo, es probable que las proteínas no catalíticas interactúen con las proteínas enzimáticamente activas, como las sintasas y las depolimerasas, afectando la velocidad de producción de PHA.
Además de los genes estructurales, phaB, phaA y phaC, en la misma región del genoma de Azotobacter se han encontrado otros genes asociados al metabolismo de los PHA. Entre ellos se encuentran, el gen phaP, el cual codifica para una proteína asociada a los gránulos de PHA, y los genes phaF y phaR, que poseen una posible función regulatoria de la síntesis y acumulación de PHA y son homólogos a genes involucrados en la producción de PHA en otros microorganismos .
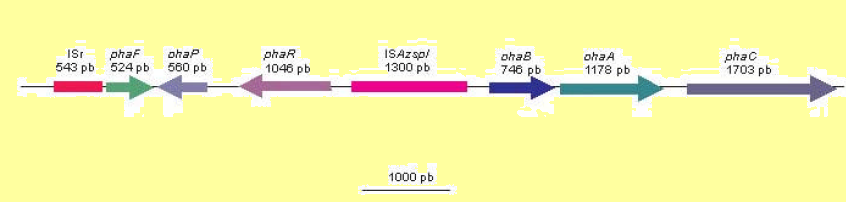
Organización genética de la región pha de Azotobacter. Las flechas indican el sentido de la transcripción. La barra representa una longitud de 1000 pares de bases (pb).
Por otro lado, también se ha identificado una secuencia de inserción completa (ISAzspI) y los restos de otra (ISr), situadas a ambos lados del grupo formado por los genes phaF, phaP y phaR. Esto sugiere la posibilidad de que estos genes hayan sido transferidos a Azotobacter a partir de otro microorganismo mediante un mecanismo que involucra secuencias de inserción.
5.2.3 Producción de PHB en Escherichia coli recombinante
Ya en el apartado dedicado a la síntesis de PHA en microorganismos, en la parte 3.2, comencé a tratar el tema de la síntesis de PHB en la bacteria E. Coli. Ahora haremos un breve repaso de lo que allí se dijo y ampliaremos el proceso de síntesis para conocer los detalles del mismo.
Los productores naturales de PHA, como Azotobacter, se han adaptado a la acumulación de estos polímeros durante la evolución, pero normalmente tienen un tiempo de generación largo y temperaturas de crecimiento relativamente bajas. Además, son difíciles de lisar y poseen enzimas que degradan el polímero acumulado. Estas características dificultan su uso en la producción industrial de los biopolímeros.
Por ello se empleará la bacteria Escherichia coli para producir indirectamente PHA debido a sus buenas propiedades biotecnológicas
Entre las cepas bacterianas comúnmente utilizadas en procesos biotecnológicos, E. coli es el microorganismo mejor conocido, ya que su metabolismo ha sido extensivamente estudiado y caracterizado. Debido a esto, es un microorganismo ideal para su uso en fermentaciones. Además, debido al gran número de herramientas disponibles para realizar manipulaciones genéticas, es el organismo adecuado para realizar ensayos previos al traspaso de los genes a plantas.
E. coli no posee la capacidad de sintetizar o degradar PHA pero crece rápido y es fácil de lisar. Se empleará esta bacteria para producir indirectamente PHA debido a sus buenas propiedades biotecnológicas. Se han expresado los genes pha de varias especies bacterianas en E.coli, obteniéndose buenos rendimientos del polímero. Asimismo, al no poseer enzimas que degraden a los PHA, permite la acumulación de polímero con un elevado peso molecular.
Los genes necesarios para la síntesis de PHB de Azotobacter (phaB, phaA y phaC) han sido clonados y caracterizados en el laboratorio y transferidos a una cepa de E. coli adecuada para la producción del polímero.
Para lograr una buena acumulación del polímero en E.coli recombinante es necesario utilizar vectores de expresión estables con un alto número de copias, pues uno de los mayores desafíos del sistema es la expresión estable y sostenida de los genes pha. Para esto, se construyó un plásmido recombinante introduciendo los genes pha de Azotobacter bajo la regulación del promotor lactosa en un vector de expresión de alto número de copias. Este plásmido se transfirió a E. coli y permitió la obtención de PHB en la cepa recombinante a partir de glucosa.
La cepa utilizada también degrada lactosa, por lo que se analizó la producción del polímero utilizando lactosa y también lactosuero en un medio salino, obteniéndose una buena cantidad de polímero en ambos casos.
En este momento se están realizando las pruebas piloto para aumentar la escala del proceso, con el objeto de desarrollar un proceso económicamente atractivo de producción del polímero, ya que el medio de cultivo utilizado solamente contiene sales y lactosuero, un desecho de la industria láctea, como fuente de carbono. La utilización del lactosuero tiene una ventaja adicional, ya que se trata de un desecho contaminante cuya eliminación adecuada involucra un costo elevado. Su utilización como sustrato de una fermentación cuyo producto es una sustancia con un buen valor económico implica entonces un doble beneficio.